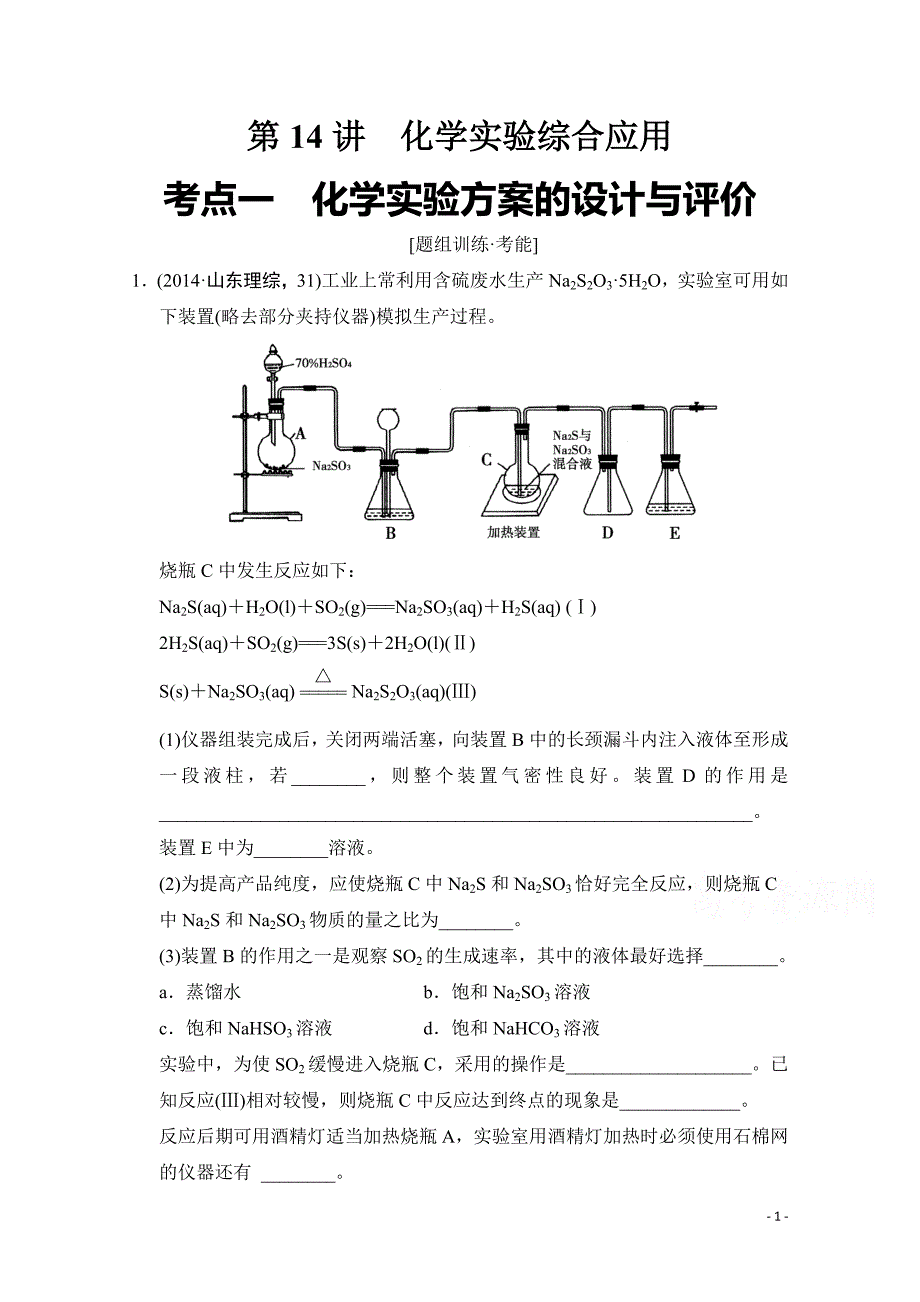
-1-第第 14 讲讲化学实验综合应用化学实验综合应用 考点一化学实验方案的设计与评价 题组训练考能 1(2014山东理综,31)工业上常利用含硫废水生产 Na2S2O35H2O,实验室可用如下装置(略去部分夹持仪器)模拟生产过程。烧瓶 C 中发生反应如下:Na2S(aq)H2O(l)SO2(g)=Na2SO3(aq)H2S(aq)()2H2S(aq)SO2(g)=3S(s)2H2O(l)()S(s)Na2SO3(aq)=Na2S2O3(aq)()(1)仪器组装完成后,关闭两端活塞,向装置 B 中的长颈漏斗内注入液体至形成一段液柱,若_,则整个装置气密性良好。装置 D 的作用是_。装置 E 中为_溶液。(2)为提高产品纯度,应使烧瓶 C 中 Na2S 和 Na2SO3恰好完全反应,则烧瓶 C中 Na2S 和 Na2SO3物质的量之比为_。(3)装置 B 的作用之一是观察 SO2的生成速率,其中的液体最好选择_。a蒸馏水 b饱和 Na2SO3溶液 c饱和 NaHSO3溶液 d饱和 NaHCO3溶液 实验中,为使 SO2缓慢进入烧瓶 C,采用的操作是_。已知反应()相对较慢,则烧瓶 C 中反应达到终点的现象是_。反应后期可用酒精灯适当加热烧瓶 A,实验室用酒精灯加热时必须使用石棉网的仪器还有 _。-2-a烧杯 b蒸发皿 c试管 d锥形瓶 (4)反应终止后,烧瓶 C 中的溶液经蒸发浓缩、冷却结晶即可析出 Na2S2O35H2O,其中可能含有 Na2SO3、Na2SO4等杂质。利用所给试剂设计实验,检测产品中是否存在 Na2SO4,简要说明实验操作、现象和结论:_ _ _。已知 Na2S2O35H2O 遇酸易分解:S2O232H=SSO2H2O 供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液 解析(1)若装置不漏气,则长颈漏斗中会形成一段液柱并且液柱高度保持不变;装置 D 是安全瓶,可防止倒吸;装置 E 是尾气处理装置,用来吸收过量的SO2,故所盛溶液可以是 NaOH 溶液等。(2)根据盖斯定律,由()2()()3,得 2Na2S(aq)Na2SO3(aq)3SO2(g)=3Na2S2O3(aq),故烧瓶 C 中 Na2S 和 Na2SO3物质的量之比为 21。(3)装置 B 中的溶液不能和 SO2发生反应。蒸馏水溶解 SO2;Na2SO3溶液能与SO2发生反应:SO2Na2SO3H2O=2NaHSO3;NaHCO3溶液也能与 SO2发生反应:NaHCO3SO2=CO2NaHSO3;饱和 NaHSO3溶液不能和 SO2反应,也不溶解 SO2。为使 SO2缓慢进入烧瓶 C,应使生成 SO2的速率减慢,可通过控制滴加硫酸的速度来实现;因反应()相对较慢,C 中反应达到终点时 S 消耗完,现象是溶液变澄清。蒸发皿加热时不需垫石棉网;试管是小型玻璃仪器,加热时也不需垫石棉网;烧杯、锥形瓶底部面积大,防止受热不均匀,在加热时需垫石棉网。(4)Na2S2O3和 Na2SO3的存在对 SO24的检验有干扰,要先除去。根据题给信息,可先加入过量的稀盐酸将二者除去,排除干扰,再检验 SO24的存在。答案(1)液柱高度保持不变防止倒吸NaOH(合理即可)(2)21(3)c控制滴加硫酸的速度(合理即可)溶液变澄清(或浑浊消失)ad(4)取少量产品溶于足量稀盐酸,静置,取上层溶液(或过滤,取滤液),滴加 BaCl2溶液,若出现沉淀则说明含有 Na2SO4杂质(合理即可)-3-2(2014济南冲刺)氯气和漂白粉是现代工业和生活常用的消毒剂、杀菌剂。(1)实验室拟用下列装置制备干燥纯净的氯气,请按照气体从左向右流动的方向将仪器进行连接:H_、_、_;并指出其中广口瓶中的试剂为_。(2)写出工业上用氯气和石灰乳制取漂白粉的化学反应方程式_。(3)实验室有一瓶密封不严的漂白粉样品,其中肯定存在 CaCl2,请设计实验,探究该样品中除 CaCl2外可能存在的其他固体物质。提出合理假设。假设 1:该漂白粉未变质,只含_;假设 2:该漂白粉全部变质,只含_;假设 3:该漂白粉部分变质,既含有 Ca(ClO)2又含有 CaCO3。设计实验方案,进行实验。限选用的仪器和药品:试管、滴管、带导管的单孔塞、蒸馏水、自来水、1 molL1盐酸、品红溶液、新制澄清石灰水。(提示:不必检验 Ca2和 Cl。)实验步骤 预期现象与结论 步骤 1 取少量上述漂白粉于试管中,_ 步骤 2 解析(1)装置的连接顺序是制备装置洗气除杂(除去氯化氢)干燥装置收集装置尾气吸收装置。除去氯气中的氯化氢最好用饱和食盐水溶液。(3)漂白粉的成分是 Ca(ClO)2和 CaCl2,在空气中变质后生成 CaCO3,由于肯定存在-4-CaCl2,所以除 CaCl2外,可能存在的其他固体物质就有三种假设:只有 Ca(ClO)2,只有 CaCO3,既含有 Ca(ClO)2又含有 CaCO3。将样品与盐酸混合,CaCO3能产生 CO2,借助于澄清石灰水检验其存在;Ca(ClO)2能将盐酸氧化为氯气,借助于品红溶液检测其存在。答案(1)BACDE饱和食盐水(2)2Cl22Ca(OH)2=CaCl2Ca(ClO)22H2O(3)Ca(ClO)2CaCO3 实验步骤 预期现象与结论 步骤 1 加入适量 1 molL1盐酸 溶解后,再将产生的气体 通入澄清石灰水中 若澄清石灰水未变浑浊,则假设1 成立;若澄清石灰水变浑浊,则假设 2 或假设 3 成立 步骤 2 向步骤 1 反应后的试管中 滴入 12 滴品红溶液,振荡 结合步骤 1 中的:a.若品红溶液褪色,则假设 3 成立;b.若品红溶液不褪色,则假设 2 成立 思维建模 三种常见实验方案设计的基本流程 1物质制备实验方案 设计的基本流程为:根据目标产物确定可能原理设计可能实验方案优化实验方案选择原料设计反应装置(方法、仪器等)实施实验(步骤、操作要点、控制反应条件等)分离提纯产品。2性质探究性实验方案 设计的基本流程为:根据物质的组成、结构和类型提出性质猜想设计实验逐个验证记录现象和数据归纳分析合理推断得出结论。3性质验证实验方案 设计的基本流程为:根据物质的性质设计可能实验方案优化实验方案实施实验(原理、方法、步骤、仪器、药品、操作要点等)观察现象记录数据综合分析得出结论。3(2014西安联考)信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含 70%Cu、25%Al、4%Fe 及少量 Au、Pt 等金属的混合物,并设计出如下制备硫酸铜和硫-5-酸铝晶体的路线:请回答下列问题:(1)第步 Cu 与酸反应的离子方程式为_;得到滤渣 1 的主要成分为_。(2)第步加 H2O2的作用是_,使用 H2O2的优点是_;调溶液 pH 的目的是使_生成沉淀。(3)用第步所得 CuSO45H2O 制备无水 CuSO4的方法是_。(4)由滤渣 2 制取 Al2(SO4)318H2O,探究小组设计了三种方案:上述三种方案中,_方案不可行,原因是_:从原子利用率角度考虑,_方案更合理。(5)探究小组用滴定法测定 CuSO45H2O(Mr250)含量。取 a g 试样配成 100 mL溶液,每次取 20.00 mL,消除干扰离子后,用 c mol L1 EDTA(H2Y2)标准溶液滴定至终点,平均消耗 EDTA 溶液 b mL。滴定反应如下:Cu2 H2Y2=CuY22H-6-写出计算 CuSO45H2O 质量分数的表达式 w_;下列操作会导致 CuSO45H2O 含量的测定结果偏高的是_。a未干燥锥形瓶 b滴定终点时滴定管尖嘴中产生气泡 c未除净可与 EDTA 反应的干扰离子 解析(1)第步加稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe 发生反应生成 Cu2、Al3、Fe2。所以滤渣 1 的成分是 Pt 和 Au,滤液 1 中的离子是 Cu2、Al3、Fe2。Cu 和酸反应的离子方程式为 Cu4H2NO 3=Cu22NO22H2O 或 3Cu8H2NO 3=3Cu22NO4H2O;(2)第步加H2O2的作用是把 Fe2氧化为 Fe3,该氧化剂的优点是不引入杂质,产物对环境无污染。调溶液 pH 的目的是使 Fe3和 Al3形成沉淀。所以滤液 2 的成分是Cu2,滤渣 2 的成分为氢氧化铁和氢氧化铝;(3)用第步所得 CuSO45H2O 制备 CuSO4的方法应是在坩埚中加热脱水;(4)甲方案在滤渣中只加硫酸会生成Fe2(SO4)3和 Al2(SO4)3,冷却、结晶、过滤得到的硫酸铝晶体中混有大量硫酸铁杂质,方法不可行;乙和丙方法均可行,乙方案先在滤渣中加 H2SO4,生成Fe2(SO4)3和 Al2(SO4)3,再加 Al 粉和 Fe2(SO4)3反应生成 Al2(SO4)3和 Fe,过滤后,蒸发、冷却、结晶、过滤可得硫酸铝晶体;丙方案先在滤渣中加 NaOH,和 Al(OH)3反应生成 NaAlO2,过滤后再在滤液中加 H2SO4生成 Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体,但从原子利用率角度考虑方案乙更合理;(5)CuSO45H2O 质量分数的表达式为 w c molL1 b 103 L 250 gmol1 5a g100%;滴定时,未干燥锥形瓶,不影响测定结果;若滴定终点时滴定管尖嘴中产生气泡,所读取的消耗标准溶液的体积偏小,使测定结果偏低;若未除尽可与 EDTA 反应的离子,消耗EDTA 溶液的体积偏大,使测定结果偏高。答案(1)Cu4H2NO 3=Cu22NO22H2O 或 3Cu8H2NO 3=3Cu22NO4H2OAu、Pt-7-(2)将 Fe2氧化成 Fe3不引入杂质,对环境无污染Fe3、Al3(3)加热脱水(4)甲所得产品中含有较多 Fe2(SO4)3杂质乙(5)c molL1 b 103 L 250 gmol1 5a g100%c
网站客服QQ:2055934822
金锄头文库版权所有
经营许可证:蜀ICP备13022795号 | 川公网安备 51140202000112号