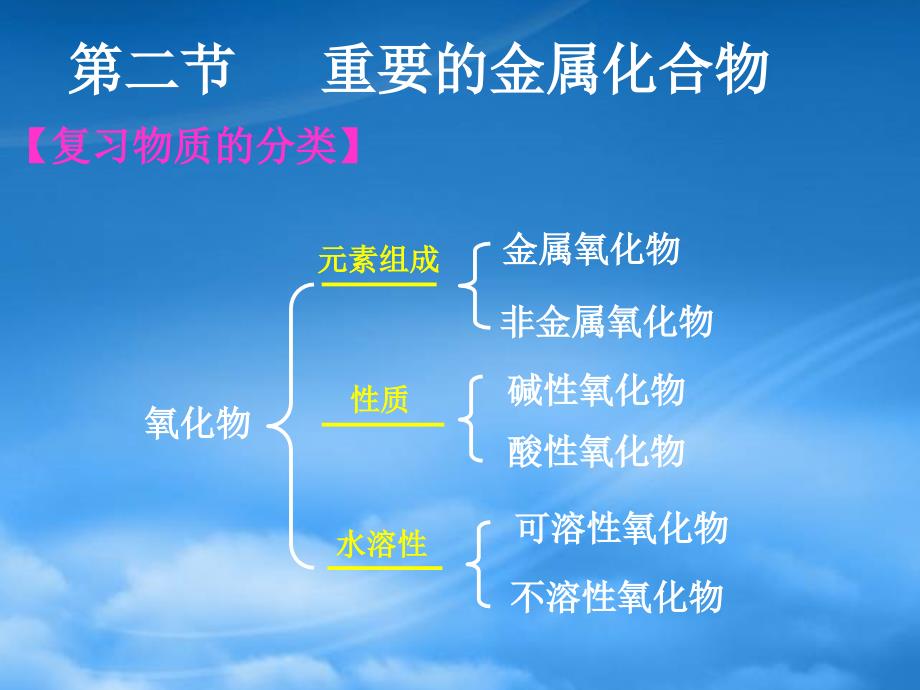
氧化物氧化物元素组成元素组成金属氧化物金属氧化物非金属氧化物非金属氧化物性质性质碱性氧化物碱性氧化物酸性氧化物酸性氧化物水溶性水溶性可溶性氧化物可溶性氧化物不溶性氧化物不溶性氧化物第二节第二节 重要的金属化合物重要的金属化合物 【复习物质的分类】【复习物质的分类】一、金属氧化物的性质一、金属氧化物的性质1、水溶性、水溶性(1)多数金属氧化物不溶于水;)多数金属氧化物不溶于水;(2)少数与水反应生成对应的碱。如)少数与水反应生成对应的碱。如Na2O,CaO等等CaO + H2O = Ca(OH)2Na2O + H2O = 2NaOH红棕色红棕色多数不溶于水的氧化物能与酸反应生成盐和水。多数不溶于水的氧化物能与酸反应生成盐和水。2、与酸的反应、与酸的反应 (实验实验35)无色溶液无色溶液黄色溶液黄色溶液蓝色溶液蓝色溶液MgO+2HCl=MgCl2+H2OFe2O3+6HCl=2FeCl3+3H2OCuO+2HCl=CuCl2+H2O思考:思考:铝能与盐酸和氢氧化钠反应,那么铝的氧化物能铝能与盐酸和氢氧化钠反应,那么铝的氧化物能否与酸和碱反应?否与酸和碱反应?Al2O3 + 6HCl = 2AlCl3 + 3H2OAl2O3 + 2NaOH = 2NaAlO2 + H2O两性氧化物两性氧化物Al2O33、金属氧化物的用途、金属氧化物的用途Al两性元素两性元素阅读课本阅读课本P47P471铁的氢氧化物铁的氢氧化物氢氧化亚铁:氢氧化亚铁:氢氧化铁:氢氧化铁:可溶性亚铁盐与强碱溶液反应可溶性亚铁盐与强碱溶液反应可溶性铁盐与强碱溶液反应可溶性铁盐与强碱溶液反应Fe2+ +OH-= Fe(OH)2Fe3+OH-= Fe(OH)3二、金属氢氧化物二、金属氢氧化物(阅读溶解性表阅读溶解性表)(白色絮状沉淀)(白色絮状沉淀)(红褐色沉淀)(红褐色沉淀)生成红褐色的沉淀生成红褐色的沉淀先生成白色絮状沉淀,迅速变先生成白色絮状沉淀,迅速变为灰绿色,最后变红褐色为灰绿色,最后变红褐色FeCl3+3NaOH=Fe(OH)3 +3NaClFeSO4+2NaOH=Fe(OH)2 +Na2SO4红褐色红褐色 Fe(OH)3白色絮状白色絮状 灰绿色灰绿色 红褐色红褐色很快很快最终最终 Fe(OH)2 Fe(OH)3思考:思考:白色絮状很快变色,为什么?白色絮状很快变色,为什么?FeSO4+2NaOH=Fe(OH)2 +Na2SO44Fe(OH)2+O2+2H2O=4Fe(OH)3思考题思考题:若要制备氢氧化亚铁,应该怎样操作?若要制备氢氧化亚铁,应该怎样操作?Fe(OH)3为红褐色固体,受热会分解为红棕色为红褐色固体,受热会分解为红棕色Fe2O32Fe(OH)3 = Fe2O3+3H2O加热加热Fe3+的检验方法:的检验方法:Fe3+遇遇SCN显红色显红色Fe3+ + 3SCN- = Fe(SCN)31 1Fe(OH)Fe(OH)2 2和和Fe(OH)Fe(OH)3 3均为不溶性弱碱,均为不溶性弱碱,Fe(OH)Fe(OH)2 2为白色固体,为白色固体,在空气中很容易被氧化成在空气中很容易被氧化成Fe(OH)Fe(OH)3 3,Fe(OH)Fe(OH)3 3为红褐色固体,为红褐色固体,受热会分解为红棕色受热会分解为红棕色FeFe2 2O O3 3和和H H2 2O O;2 2FeFe3+3+具有强氧化性而具有强氧化性而FeFe2+2+有还原性,有还原性,FeFe2+2+和和FeFe3+3+在一定条件在一定条件下相互转化;下相互转化; Fe Fe2+2+ Fe Fe3+3+e e_ _3 3掌握掌握FeFe3+3+的检验方法:的检验方法:FeFe3+3+遇遇SCNSCN显红色。显红色。 【本讲小结】本讲小结】 作业:作业:课本课本P45 6、72铝的氢氧化物铝的氢氧化物 (实验(实验37)氢氧化铝的氢氧化铝的实验室制法实验室制法:用铝盐和氨水反应来制取用铝盐和氨水反应来制取Al2(SO4)3 + 6NH3.H2O = 2Al(OH)3 + 3(NH4)2SO4思考:思考:铝和氧化铝都能与盐酸和氢氧化钠反应,那么氢铝和氧化铝都能与盐酸和氢氧化钠反应,那么氢氧化铝能否与酸和碱反应?氧化铝能否与酸和碱反应?(实验(实验3 38 8)Al(OH)3 + 3HCl = AlCl3 + 3H2OAl(OH)3 + NaOH = NaAlO2 + 2H2O(白色胶状物白色胶状物)Al3+ + 3NH3H2O = Al(OH)3 +3NH4+2Al(OH)3 Al2O3 + 3H2O用途:用途:凝聚悬浮物、吸附色素,用来净水;胃酸中和剂凝聚悬浮物、吸附色素,用来净水;胃酸中和剂Al(OH)3是一种两性氢氧化物,但并非和所有的是一种两性氢氧化物,但并非和所有的酸碱都发生反应,其只溶于较强的酸或碱溶液酸碱都发生反应,其只溶于较强的酸或碱溶液中,如中,如碳酸、氨水碳酸、氨水等就不能溶解等就不能溶解Al(OH)3 加热时,加热时, Al(OH)3 分解为氧化铝和水分解为氧化铝和水两性氢氧化物两性氢氧化物Al(OH)3注意:注意:1碳酸钠和碳酸氢钠碳酸钠和碳酸氢钠三、盐三、盐NaNa2 2COCO3 3 俗名纯碱、苏打;俗名纯碱、苏打; NaHCO NaHCO3 3 俗名小苏打俗名小苏打【科学探究】【科学探究】 Na Na2 2COCO3 3 和和 NaHCO NaHCO3 3在水中的溶解性在水中的溶解性Na2CO3NaHCO3外观外观滴水滴水加加10mL10mL水水加酚酞加酚酞初步结论初步结论白色粉末白色粉末白色细小晶体白色细小晶体放热放热放热放热( (较少较少) )完全溶解完全溶解部分溶解部分溶解变红色(较深)变红色(较深)变红色(较浅)变红色(较浅)在水中溶解性较大;在水中溶解性较大;水溶液碱性较强水溶液碱性较强在水中溶解性较小;在水中溶解性较小;水溶液碱性较弱水溶液碱性较弱NaNa2 2COCO3 3 和和 NaHCO NaHCO3 3 的热稳定性的热稳定性【转化】【转化】NaHCO3Na2CO31固体,加热固体,加热2溶液,加溶液,加NaOH通入过量通入过量CO2结论:结论:溶解性溶解性NaNa2 2COCO3 3 NaHCO NaHCO3 3,即,即正盐正盐溶解性大于溶解性大于酸式酸式盐。(盐。(特殊:特殊:CaCOCaCO3 3溶解性小于溶解性小于Ca(HCOCa(HCO3 3) )2 2)Na2CO3NaHCO3现象现象化学方程式化学方程式初步结论初步结论无明显变化无明显变化较稳定较稳定试管口处有水珠;试管口处有水珠;澄清的石灰水变浑浊澄清的石灰水变浑浊不稳定,受热易分解不稳定,受热易分解2NaHCO2NaHCO3 3 = Na= Na2 2COCO3 3+H+H2 2O+COO+CO2 2与盐酸反应与盐酸反应NaHCO3Na2CO3产生气体速度产生气体速度较快较快产生气体速度产生气体速度较慢较慢思考:思考: 那么,滴加盐酸产生无色无味气体的物质中是那么,滴加盐酸产生无色无味气体的物质中是否就一定含有碳酸根呢?否就一定含有碳酸根呢?HCO3- + H+ = CO2 +H2OCO32- + 2H+ = CO2 + H2O作业:作业:写出课本写出课本 P4950 出现的所有化学方程式,出现的所有化学方程式,如果有离子方程式的,请写出离子方程式。如果有离子方程式的,请写出离子方程式。2 2、三价铁的氧化性、三价铁的氧化性(1 1)FeFe3+3+离子的检验离子的检验滴入滴入KSCNKSCN溶液溶液FeClFeCl3 3溶液溶液FeClFeCl2 2溶液溶液Fe3+3SCN- = Fe(SCN)3变血红色变血红色无明显变化无明显变化【科学探究】铁盐和亚铁盐的一些性质【科学探究】铁盐和亚铁盐的一些性质(血红色血红色)(2 2)FeFe3+3+离子的氧化性离子的氧化性加入加入现象现象化学方程式化学方程式资料资料P52: P52: 铜绿铜绿 Cu Cu2 2(OH)(OH)2 2COCO3 3铜盐溶液铜盐溶液可以使蛋白质变性,失去生理活性,可使人中可以使蛋白质变性,失去生理活性,可使人中毒。毒。铁粉,铁粉,KSCNKSCN溶液溶液黄色溶液变黄色溶液变为浅绿色为浅绿色2FeCl2FeCl3 3+Fe=3FeCl+Fe=3FeCl2 2加入氯水,振荡加入氯水,振荡溶液变为血溶液变为血红色红色2FeCl2FeCl2 2+Cl+Cl2 2=2FeCl=2FeCl3 3氧化剂氧化剂氧化剂氧化剂3 3、焰色反应、焰色反应金属或它们的化合物在灼烧时都会呈现特殊的颜色。金属或它们的化合物在灼烧时都会呈现特殊的颜色。实验实验3-93-9关键词:铂丝(或无锈铁丝)关键词:铂丝(或无锈铁丝) 酒精灯(最好用煤气灯)酒精灯(最好用煤气灯) 外焰灼烧外焰灼烧 用过的铂丝用盐酸洗净,灼烧用过的铂丝用盐酸洗净,灼烧钠灼烧:钠灼烧:铜灼烧:铜灼烧:钾灼烧钾灼烧:黄色黄色绿色绿色紫色紫色透过蓝色的钴玻璃观察钾离子的焰色透过蓝色的钴玻璃观察钾离子的焰色【作业】1 14 4题做在课本上题做在课本上5 5、6 6、7 7题做在作业本上题做在作业本上P54
网站客服QQ:2055934822
金锄头文库版权所有
经营许可证:蜀ICP备13022795号 | 川公网安备 51140202000112号